Симптомы и признаки
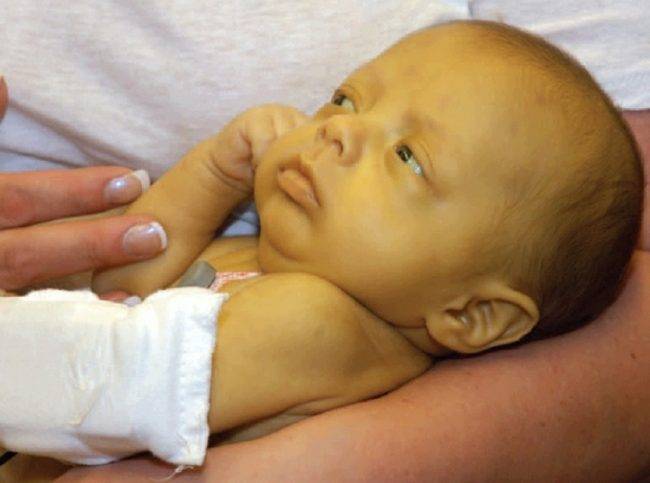 Гемолитическая болезнь новорождённых бывает разной по форме и степени тяжести — от лёгкой до крайне тяжёлой степени тяжести заболевания
Гемолитическая болезнь новорождённых бывает разной по форме и степени тяжести — от лёгкой до крайне тяжёлой степени тяжести заболевания
Характер проявлений гемолитической патологии новорождённых зависят от её формы.
Желтушная
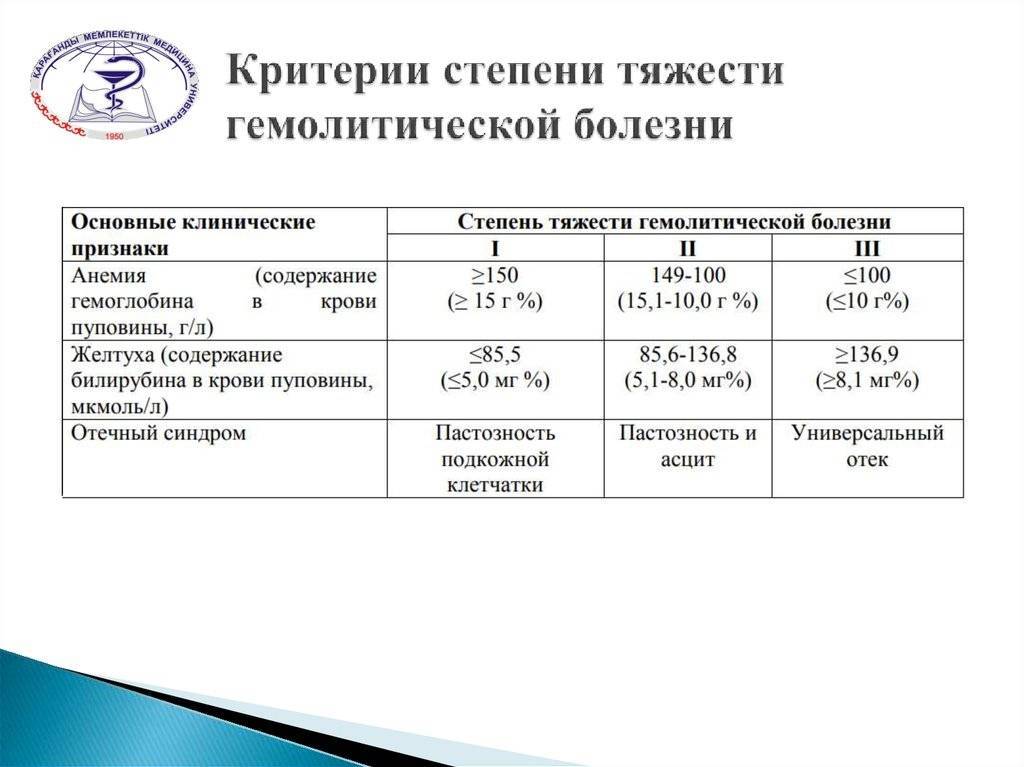
При желтушной — самой распространённой — исследование крови показывает чрезмерный уровень желчного пигмента — билирубина. Если в норме он составляет от 10,2 до 51 мкмоль/л , то у больных детей гораздо выше, что объясняется процессом масштабного разрушения эритроцитов. В случае повышения билирубина до критических цифр не исключено развитие нарушений церебрального характера, так как желчный пигмент преодолевает гематоэнцефалический барьер и наносит вред ЦНС плода. Подобное состояние именуется ядерной желтухой и проявляется следующим образом:
- сначала возникает общая вялость, падает АД, снижаются рефлексы. Ребёнок часто зевает, срыгивает пищу частично или полностью. Ест неохотно, крик его становится монотонным.
- на 3–4 сутки происходят затяжные остановки дыхания, снижение частоты сердечного ритма. Ребёнок закатывает глаза, плохо реагирует на раздражители. Апатичное и малоподвижное состояние может резко сменяться двигательной активностью и судорогами;
- к концу первого месяца неврологические симптомы сглаживаются и дают картину якобы выздоровления;
- с возраста 3–5 месяцев неврологические отклонения снова становятся заметны.
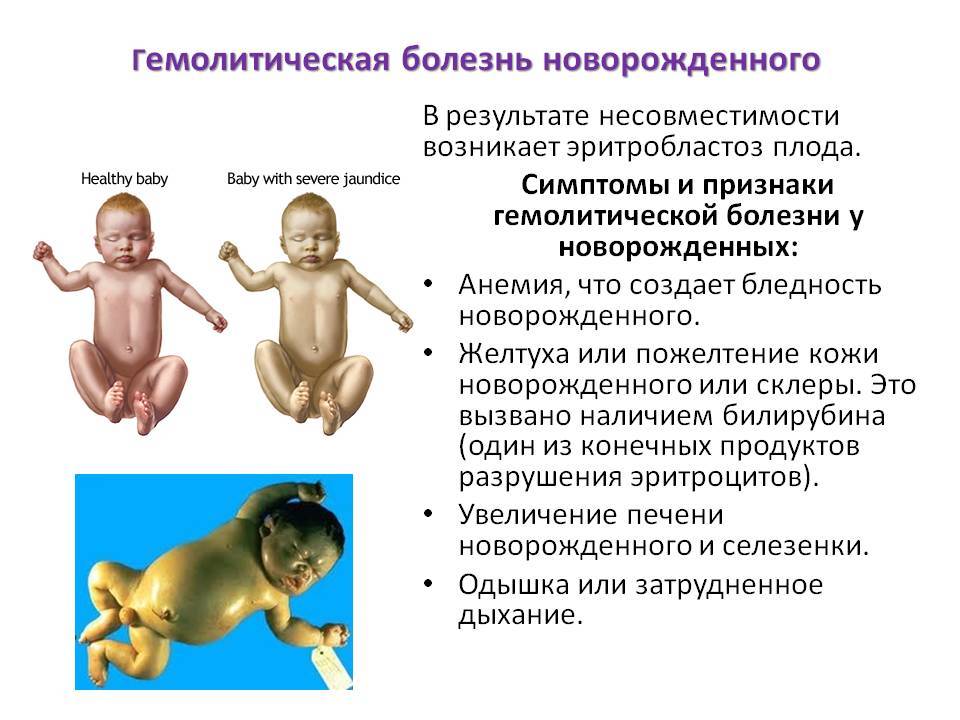
Другими типичными признаками желтушной формы являются светло-жёлтый окрас слизистых и кожи, а также увеличенная селезёнка. Не исключено появление отёков из-за проблем с выработкой белка в печени, размер которой тоже больше нормы.
Ребёнок, как правило, появляется на свет в положенный срок, с массой тела в пределах допустимого и нормальным цветом кожи. Однако через 1–2 дня появляются признаки желтухи, которые нарастают вплоть до 4 суток, но затем уходят в результате лечения. В это период моча ребёнка становится тёмной, как пиво, а кал сохраняет нормальную окраску. Реже случается так, что малыш рождается уже с жёлтым оттенком тела. Околоплодная жидкость и первородная смазка имеют такой же цвет.
Анемическая
Анемическая форма характеризуется пониженным гемоглобином и гематокритом. В числе её проявлений:
- патологическая бледность тела новорождённого;
- незначительное увеличение печени, реже — селезёнки.
В некоторых случаях симптомы анемической формы заметны уже при появлении на свет, но чаще они появляются ко 2-й неделе жизни в результате стремительного развития патологии. Помимо низкого гемоглобина, анализы крови показывают дефицит молодых форм красных кровяных клеток, при этом показатель непрямого билирубина невысок.
Отёчная
Отёчная форма считается самой опасной потому, что в особо тяжёлых случаях становится причиной смерти ребёнка ещё до рождения или в первые часы/дни после появления на свет. Среди её проявлений:
- признаки анемии;
- свободная жидкость в брюшной полости (водянка);
- выпоты в лёгких (гидроторакс);
- увеличение печени и селезёнки, которые работают с повышенной нагрузкой, но едва справляются со своими функциями;
- нарушение сердечного ритма;
- бледность кожи с признаками кровоизлияний и мацерации (размягчения, в связи с нахождением в околоплодной жидкости).
Отсутствие желтушности при появлении на свет объясняется выведением неконъюгированного билирубина будущего ребёнка через структуры плаценты, а также его разбавлением в результате увеличения объёма циркулирующей крови и плазмы (гиперволемии).
Анализы крови выявляют:
- гипопротеинемию (количество сывороточного белка в крови меньше 40–45 г/л), высокую проницаемость сосудов;
- тяжёлую форму анемии (гемоглобин в пределах 35–50 г/л, число эритроцитов от 1,0 до 1,5 • 10–12/л). Как следствие, возникает дефицит кислорода в тканях;
- большое количество незрелых или аномальных форм эритроцитов (эритробластоз).
В большинстве случаев новорождённые с отёчной разновидностью имеют низкие баллы по АПГАР из-за выраженной сердечной, а также дыхательной недостаточности. Многие требуют реанимации сразу после появления на свет. Нередко положение осложняется появлением ДВС-синдрома и развитием шоковых состояний.
Новорождённые, не получившие должной терапии, в том числе частичной замены крови в первые часы жизни, умирают из-за нарастающей полиорганной недостаточности.
Патогенез
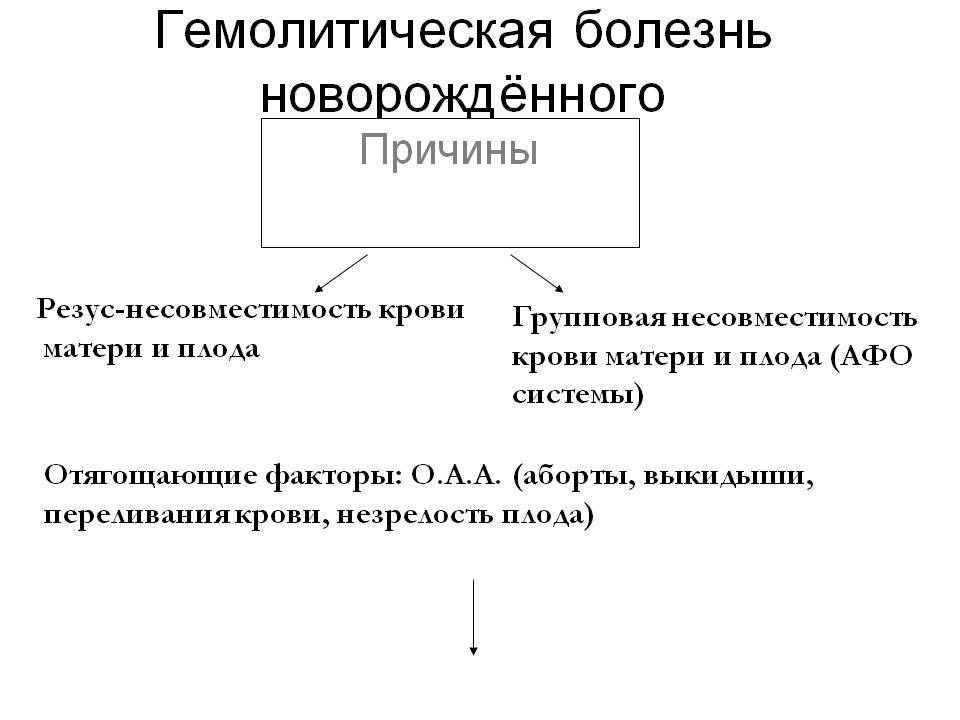
Патогенез: эритроциты плода содержат резус-фактор (Rh), унаследованный от «резус-положительного» отца, который может быть гомозиготом (Rh Rh) или гетерозиготом (Rh rh); мать — «резус-отрицательная» (rh), ее эритроциты не содержат резус-фактора, в связи с чем он по отношению к организму матери является антигеном. Через плаценту резус-фактор попадает от плода в кровь матери и вызывает у нее образование анти-Rh-агглютининов. Происходит изоиммунизация «резус-отрицательной матери» «резус-положительным плодом». Образовавшиеся анти-Rh-агглютинины поступают через плаценту от матери к плоду и вызывают у него гемолиз с последующим развитием анемии. В этом случае говорят о «резус-конфликте» между матерью и плодом. Во время родов, когда нарушается целость плацентарного барьера, в кровь рождающегося ребенка поступает особенно много анти-Rh-агглютининов, резко усиливается гемолиз его эритроцитов и нарастают клин, явления Г. б. н. Анти-Rh-агглютинины, получаемые ребенком с молоком матери, еще более усиливают у него гемолиз.
Нарушение билирубинового обмена, обусловленное интенсивным гемолизом, начинающимся еще в период внутриутробного развития, усугубляется несовершенством процессов конъюгации непрямого билирубина вследствие незрелости в печени фермента глюкуронилтрансферазы, в результате чего нарушается детоксикация непрямого билирубина и превращение его в нетоксичный прямой билирубин (диглюкуронидбилирубин).
AHTn-Rh-агглютинины образуются приблизительно у 3—5% женщин с резус-отрицательной кровью при беременности плодом с резус-положительной кровью. Повторные беременности «резус-отрицательной женщины» плодами с резус-положительной кровью, а также сделанные такой женщине раньше, иногда даже в детстве, повторные внутривенные или внутримышечные трансфузии резус-положительной крови способствуют более интенсивному образованию у нее анти-Rh-агглютининов при беременности «резус-положительным плодом». Имеют значение также состояние реактивности организма «резус-отрицательной матери», проявляющееся в повышении чувствительности к иммунизации резус-фактором, состояние эндокринной системы, имеющиеся хрон, или перенесенные в период беременности острые заболевания, повышающие проницаемость сосудистой стенки, особенно сосудов плаценты, частые искусственные прерывания беременности и т. д.
Имеет также значение и так наз. иммунологическая толерантность к резус-фактору: у «резус-отрицательных женщин», родившихся от «резус-положительных матерей», редко бывает изоиммунизация при беременности «резус-положительным плодом» (Р. А. Авдеева, 1965).
По-видимому, с этими факторами связано то, что Г. б. н. развивается не у каждого ребенка, рожденного от «резус-отрицательной матери» и «резус-положительного отца», а только у одного из 25—30.
Резус-фактор не является однородным, имеется несколько наиболее частых типов, обозначаемых Rh0, Rh0′, Rh0″, по А. Винеру, или cDe, CDe, cDE, CDE, по Фишеру— Рейсу. Резус-конфликт возникает чаще всего при несоответствии по Rh0(D), реже по другим, более слабым, антигенам. Г. б. н. возможна при несоответствии крови матери и плода по другим факторам: M, N, Hr, Kell, Kidd, Duffy. Несоответствие эритроцитов по основным группам крови AB0 также может вести к серол, конфликту: чаще всего конфликт наступает, когда ребенок (плод) имеет группу крови А или В, а мать группу 0 (см. Группы крови).
Классификация
В международной классификации болезней 10 пересмотра головная боль кодируется в рубрике R51 и относится к типичным расстройствам в работе нервной системы.
Принято выделять два основных варианта цефалгий, по этиологическому принципу:
- Первичная головная боль. К такому типу головной боли относится головная боль напряжения или тензионная головная боль, а также мигрень.
- Вторичная головная боль. Возникает не самостоятельно, т.е. формируется под влиянием какого-либо патологического процесса, протекающего в нервной ткани. Например, головная боль вторичного характера может возникать в результате онкологического поражения центральной нервной системы или из-за атеросклеротического поражения церебральных сосудов.
Помимо этиологической классификации существует и патогенетическая классификация цефалгий, которая включает такие типы, как:
- Сосудистая головная боль. Боль сосудистого характера возникает в результате спазма гладкой мускулатуры стенок сосудов, что приводит к повышению артериального давления в церебральном бассейне и ишемизации тканей головного мозга. В противоположном случае головная боль может возникать и при дилатации сосудистого русла или в результате нарушения реологических свойств крови, что также приводит к гипоксии тканей и ишемическому поражению.
- Боль мышечного напряжения. В таком варианте происходит перераздражение нервно-мышечных синапсов, что приводит к избыточному мышечному напряжению и спастичности.
- Ликвородинамическая боль. Такой тип возникает в результате изменения внутричерепного давления, в независимости от того повышение или понижение внутричерепного давления произошло. Изменение давления в желудочках головного мозга может приводить к дислокации структур головного мозга, что в конечном счёте и формирует болевые ощущения.
- Невралгическая цефалгия. Формируется в результате раздражения периферических нервных волокон в результате экстраневрального или эндоневрального патологического процесса. При этом механизм цефалгии связан с формированием очага патологической активности в ноцицептивной системе головного мозга.
- Психогенная. При этом типе не наблюдается патологических изменений в тканях анатомически близких к нервной. В таком случае происходит сбой в работе антиноцицептивной системы головного мозга, что приводит к различным расстройствам в нейромедиаторной дофаминэргической системе головного мозга и возникновению боли. Основной механизм нарушение выработки эндогенных опиатов.
- Смешанного генеза. Возникает под воздействием комбинированного влияния патологического процесса на ткани окружающие головной мозг. Патологическое влияние может быть, как одновременным, так и последовательным.
Виды ГБН
В первую очередь, стоит определить подвид.
- Эпизодическая боль проявляется не чаще, чем около 18 раз месяц, а единичный приступ длится не более получаса. Выраженность боли при этом обычно невысокая.
- Другой тип – хроническая головная боль напряжения заметно отличается высокой интенсивностью. Приступы у пациентов бывают более 20 раз в месяц, либо более 180 случаев за год. Нередко такой тип боли сопровождается появлением депрессивных состояний.
Патологическая анатомия
Патологоанатомические изменения при внутриутробной смерти плода при сроке беременности V—VII мес. (ранняя фетопатия) скудные. Изучение их затрудняется из-за аутолиза и мацерации.
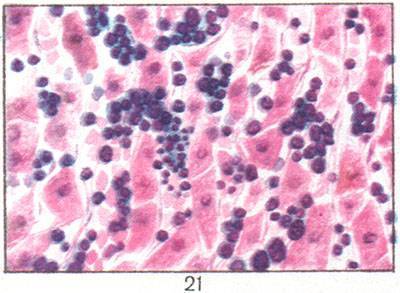
Рис. 21. Эритробластоз печени. Обилие эритробластов и нормобластов (темные клетки) в синусоидах печени при отечной форме гемолитической болезни новорожденных (окраска гематоксилин-эозином; х 400).
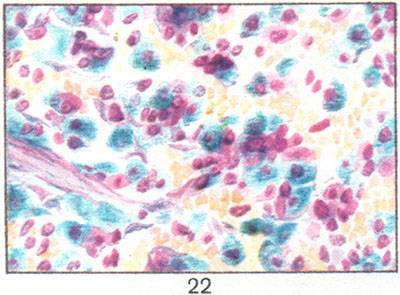
Рис. 22. Накопление гемосидерина (синего цвета) в макрофагах красной пульпы селезенки при желтушной форме гемолитической болезни новорожденных (окраска по Перльсу; х 400).
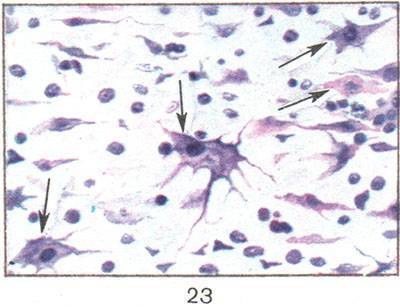
Рис. 23. Острое набухание, ишемические изменения нейронов (указано стрелками) в аммоновом роге головного мозга при желтушной форме гемолитической болезни новорожденных (окраска по Нисслю; х 400).
Отечная форма Г. б. н. характеризуется общими значительными отеками, кожа плода бледная, полупрозрачная, блестящая, частично мацерированная, с петехиальными кровоизлияниями. В полостях тела — транссудат, количество к-рого достигает 30% веса тела плода (800 мл). Сердце, печень и селезенка значительно увеличены. Почки плотны и полнокровны, сохраняют выраженную эмбриональную дольчатость. Мягкая мозговая оболочка и ткань мозга отечны и полнокровны. Вил очковая железа атрофична. Имеются признаки недоношенности: задержка формирования ядер окостенения и др. При микроскопическом исследовании определяется значительный эритробластоз в печени (цветн. рис. 21), селезенке, лимф, узлах, почках. В костном мозге — преобладание ядросодержащих клеток эритроцитарного ряда. Отмечается умеренный гемосидероз органов. В сердце находят гиперплазию мышечных волокон. В печени, надпочечниках, головном мозге отмечаются кровоизлияния, дистрофические и некробиотические изменения, плазматическое пропитывание и фибриноидные изменения мелких сосудов. Изменения головного мозга характерны для состояния хронической гипоксии. Даже у доношенных плодов имеются признаки тканевой незрелости. Плацента отечна, с признаками преждевременной инволюции.
При анемической форме Г. б. н. выражены общая бледность покровов и малокровие внутренних органов. В печени и селезенке находят умеренный эритробластоз. Дистрофические и некробиотические изменения в органах незначительные. Изменения головного мозга выражены менее резко, чем при отечной форме. Смерть может наступить в период новорожденности от интеркуррентного заболевания.
Жeлтушная форма Г. б. н. характеризуется желтушностью покровов. В желтый цвет прокра-щены также подкожный жировой слой и интима крупных сосудов. Количество непрямого билирубина в сыворотке крови может достигать 20—40 мг% . В брюшной и плевральной полостях, в полости перикарда— небольшое количество прозрачной жидкости желтого цвета. Ядра головного мозга — гиппокамп, область дна ромбовидной ямки, нижние оливы, ядро подбугорья, бледное ядро, зубчатое ядро мозжечка — интенсивно прокрашиваются билирубином в охряно-желтый цвет (так наз. ядерная желтуха). Печень и селезенка увеличены. Последняя плотная, коричнево-красная на разрезе. В почках развиваются билирубиновые инфаркты (см.). В миокарде выявляются дистрофия и вакуолизация мышечных волокон. При микроскопическом исследовании обнаруживают дистрофические и некротические изменения (острое набухание, ишемические изменения) ганглиозных клеток головного мозга (цветн. рис. 23). Тяжесть поражения мозга усугубляется гипоксией из-за повреждений мелких сосудов. В печени и селезенке резко выражен гемосидероз (цветн. рис. 22), но эритробластоз менее значительный, чем при отечной форме. В печени, кроме того, обнаруживают желчные стазы, тромбы, иногда с образованием желчных камней.
Лечение Гемолитической болезни плода и новорожденного:
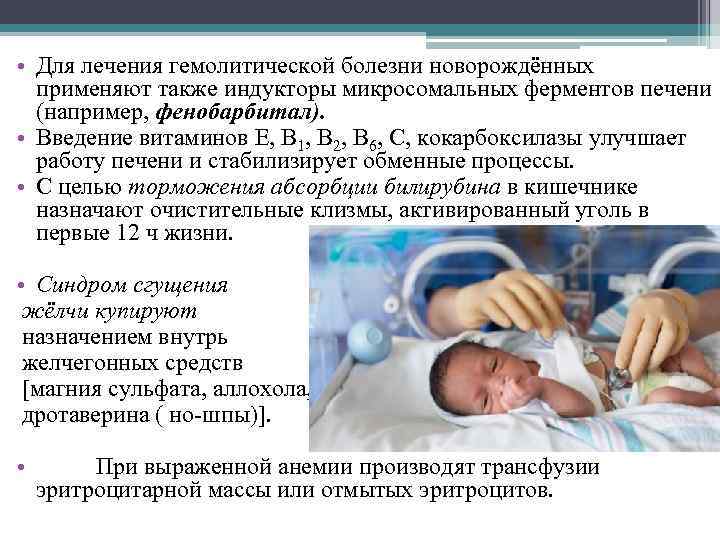
Лечение гемолитической болезни новорожденного – достаточно длительная и сложная задача. В тяжелых случаях на первом месте стоят борьба с асфиксией и коррекция ацидоза. Одним из методов лечения тяжелых форм гемолитической болезни новорожденных до сих пор является обменное переливание крови.
Впервые трансфузию эритроцитов при гемолитической болезни новорожденных применили в 1927 г. В тот период переливали кровь, совместимую лишь по системе АВ0, и часто использовали кровь отца. Смертность при данной манипуляции составляла 40%. После открытия резус-фактора и выяснения причин гемолитической болезни новорожденного детям начали переливать резус-отрицательную кровь, что снизило летальность до 30%. В дальнейшем женщин стали родоразрешать на 2-3 недели раньше положенного срока и переливать резус-отрицательную кровь; смертность снизилась до 20%, а после введения в практику обменных переливаний крови смертность составляет около 10%.
Следует отметить, что заменные переливания нередко дают серьезные осложнения, в первую очередь при нарушении техники переливаний. Необходимо использовать только свежую кровь, хранившуюся ни в коем случае не более 4 дней (лучше не более 2 дней). Вводить кровь следует не очень быстро, не быстрее 10 мл/мин. Иногда причиной смерти становится воздушная эмболия. Введение холодной крови может привести к остановке сердца, приступу удушья. Одним из осложнений заменных переливаний может быть синдром диссеминированного внутрисосудистого свертывания, как при массивных переливаниях крови. На первом этапе этого синдрома возможны тромботические осложнения, в том числе тромбозы портальных вен, затем может развиться выраженная кровоточивость с падением уровня тромбоцитов. Недостаточная асептика может вызвать септические осложнения. Как и все переливания, заменные переливания чреваты опасностью сывороточного гепатита. Заменные переливания, спасающие много новорожденных, можно использовать лишь при серьезных показаниях. Для их определения следят за уровнем непрямого билирубина, исследуют его прирост. У доношенных детей прирост, превышающий 5,2 мкмоль/л, а у недоношенных – 1,7 мкмоль/л, требует заменного переливания крови. Следует иметь в виду, что максимальный уровень билирубина при этой форме наблюдается на 3–4-й день болезни. Заменные переливания рекомендуются лишь при повышении уровня билирубина до 250-300 мкмоль/л. Используется кровь группы 0, совпадающая с резус-принадлежностью ребенка.
У доношенных новорожденных гемолитическая анемия, связанная с резус-несовместимостью, часто тяжелее, чем у детей, рожденных за 2-3 недели до срока. Это связано с меньшим количеством резус-антигена на поверхности эритроцитов у недоношенного ребенка. В отличие от резус-конфликта при болезни АВ0 никогда не прибегают к досрочному родоразрешению.
При нетяжелых формах гемолитической болезни новорожденного, связанной как с резус-несовместимостью, так и с несовместимостью по системе АВ0, можно использовать фенобарбитал, активирующий фермент глюкокуронилтрансферазу, необходимый для глюкуронирования билирубина. Иногда фенобарбитал назначают женщине в течение 2 недель до родов, но чаще лечение фенобарбиталом проводят новорожденному с нерезкой гипербилирубинемией в дозе 4 мг/(кг/сут.). В нетяжелых случаях гемолитической болезни новорожденного используется светотерапия. Электромагнитные волны видимой части спектра (420-460 ммк) переводят непрямой билирубин в безвредные, растворимые в воде соединения (дипиролы), которые легко выделяются из организма. Эффективность такой терапии невелика.
Патофизиология
Антитела вырабатываются, когда организм подвергается воздействию антигена, чужеродного для организма. Если мать подвергается воздействию чужеродного антигена и продуцирует IgG (в отличие от IgM, который не проникает через плаценту), IgG будет нацеливаться на антиген, если он присутствует у плода, и может повлиять на него внутриутробно и сохраниться после родов. Три наиболее распространенных модели, в которых женщина становится сенсибилизированной к определенному антигену (т. Е. Вырабатывает антитела IgG против), — это кровотечение, переливание крови и несовместимость по системе АВО.
Кровоизлияние у плода и матери , которое представляет собой движение клеток крови плода через плаценту, может происходить во время аборта , внематочной беременности , родов , разрывов плаценты во время беременности (часто вызванных травмой) или медицинских процедур, проводимых во время беременности, которые нарушают стенка матки. При последующих беременностях, если у плода наблюдается аналогичная несовместимость, эти антитела могут проникать через плаценту в кровоток плода, прикрепляться к эритроцитам и вызывать их разрушение ( гемолиз ). Это основная причина ГБН, потому что 75% беременностей приводят к контакту между кровью плода и матери, а у 15–50% беременностей наблюдаются кровотечения с потенциалом иммунной сенсибилизации. Количество крови плода, необходимое для сенсибилизации матери, зависит от иммунной системы человека и колеблется от 0,1 мл до 30 мл.
Возможно, женщине сделали терапевтическое переливание крови . Типирование системы групп крови ABO и антигена D резус (Rh) системы групп крови является обычным делом перед переливанием. Были высказаны предложения, что женщинам детородного возраста или молодым девушкам не следует делать переливание Rhc-положительной крови или Kell 1 -положительной крови, чтобы избежать возможной сенсибилизации, но это приведет к перегрузке ресурсов служб переливания крови, и это в настоящее время считается неэкономичным проводить скрининг на эти группы крови. HDFN также может быть вызвана антителами к множеству других антигенов системы группы крови , но Kell и Rh встречаются наиболее часто.
Третья модель сенсибилизации может возникать у женщин с группой крови O. Иммунный ответ на антигены A и B, широко распространенные в окружающей среде, обычно приводит к продукции IgM или IgG анти-A и анти-B антител в раннем возрасте. Женщины с группой крови O более склонны, чем женщины с типом A и B, к выработке IgG-антител к A и анти-B, и эти IgG-антитела способны проникать через плаценту. По неизвестным причинам частота материнских антител против антигенов типа A и B типа IgG, которые потенциально могут вызвать гемолитическую болезнь новорожденного, выше, чем наблюдаемая частота «болезни АВО». Около 15% беременностей происходит от матери типа O и ребенка типа A или типа B; только 3% этих беременностей заканчиваются гемолитической болезнью из-за несовместимости A / B / O. В отличие от антител к антигенам A и B, резус-антитела обычно не образуются при воздействии антигенов окружающей среды. В случаях несовместимости по системе ABO и несовместимости по резус-фактору риск аллоиммунизации снижается, поскольку эритроциты плода удаляются из материнского кровотока из-за антител против ABO до того, как они могут вызвать анти-резус-ответ.
Специфические антитела
- Anti-D — единственная предотвратимая форма ГБН. После введения в 1968 г. иммуноглобулина Rho-D ( Rhogam ), который предотвращает выработку материнских антител Rho-D, заболеваемость анти-D HDN резко снизилась.
- И анти-C, и анти-c могут показывать отрицательный DAT, но все же имеют тяжелое поражение младенца. Непрямой Кумбс также должен быть запущен.
- Anti-M также рекомендует тестирование на антигены, чтобы исключить наличие HDN, поскольку прямые половые клетки могут дать отрицательный результат у серьезно пораженного ребенка.
- Anti-Kell может вызвать тяжелую анемию независимо от титра. Anti-Kell подавляет костный мозг, подавляя клетки-предшественники эритроидных клеток.
- Антигены Kidd также присутствуют на эндотелиальных клетках почек.
- Одно исследование, проведенное Мораном и др., Показало, что титры анти-E ненадежны. Их наиболее тяжелый случай гемолитической болезни новорожденных произошел с титрами 1: 2. Моран заявляет, что было бы неразумно отвергать анти-Е как имеющий незначительные клинические последствия.
Вероятность конфликта если мать резус-негативная, а отец резус-позитивный
Очень часто женщина, имеющая отрицательный резус беспокоится о своем будущем потомстве, даже еще не будучи беременной. Её пугает возможность развития резус-конфликта. Некоторые даже боятся вступить брак с резус-положительным мужчиной.
Но так ли это обосновано? И какова вероятность развития иммунологического конфликта в такой паре?
К счастью, признак о резус-принадлежности кодируется так называемыми аллельными генами. Что это значит? Дело в том, что информация расположена в одних и тех же участках парных хромосом может быть разная:
- Аллель одного гена содержит доминантный признак, который является ведущим и проявляется у организма (в нашем случае – резус-фактор положительный, обозначим его большой буквой R);
- Рецессивный признак, который не проявляется и подавляется доминантным признаком (в рассматриваемом случае – отсутствие резус-антигена, обозначим его маленькой буквой r).
Что нам дает эта информация?
Суть в том, что человек, который является резус-положительным, может содержать в своих хромосомах либо два доминантных признака (RR), либо одновременно доминантный и рецессивный (Rr).
При этом мать, которая резус-негативна, содержит только два рецессивных признака (rr). Как известно, при наследовании каждый из родителей может отдать своему ребенку только один признак.
Полезное видео про гемолитическую болезнь новорожденных
https://www.youtube.com/watch?v=w2LWlJ87h64
Список источников:
- Алексеенкова М. В. Гемолитическая болезнь новорожденных: перинатальные исходы и отдаленные результаты развития детей: дис. канд. мед. наук: 14.00.09. – Москва, 2005. – 142 с.
- Сидельникова В. М., Антонов А. Г. Гемолитическая болезнь плода и новорожденного. // М., Издательство «Триада-Х», 2004. – 195.
- Касько Л. П., Шишко Г. А., Артюшевская М. В. и др. Алгоритм диагностики и лечения резус-иммунизации у беременных и новорожденных (инструкция по применению). // Минск, 2008.
Автор
Оксана Белокур
Врач педиатр
Поделиться
Вы здесь:
Главная
»
Детские болезни
»
Гемолитическая болезнь новорожденных